Kovalent ve İyonik Karakter
Kimyada, bağlar iki ana kategoriye ayrılır: kovalent bağlar ve iyonik bağlar. Bağın karakteri, bağlanan atomların elektronegatiflik farklarına bağlıdır.
Kovalent Karakter Nedir?
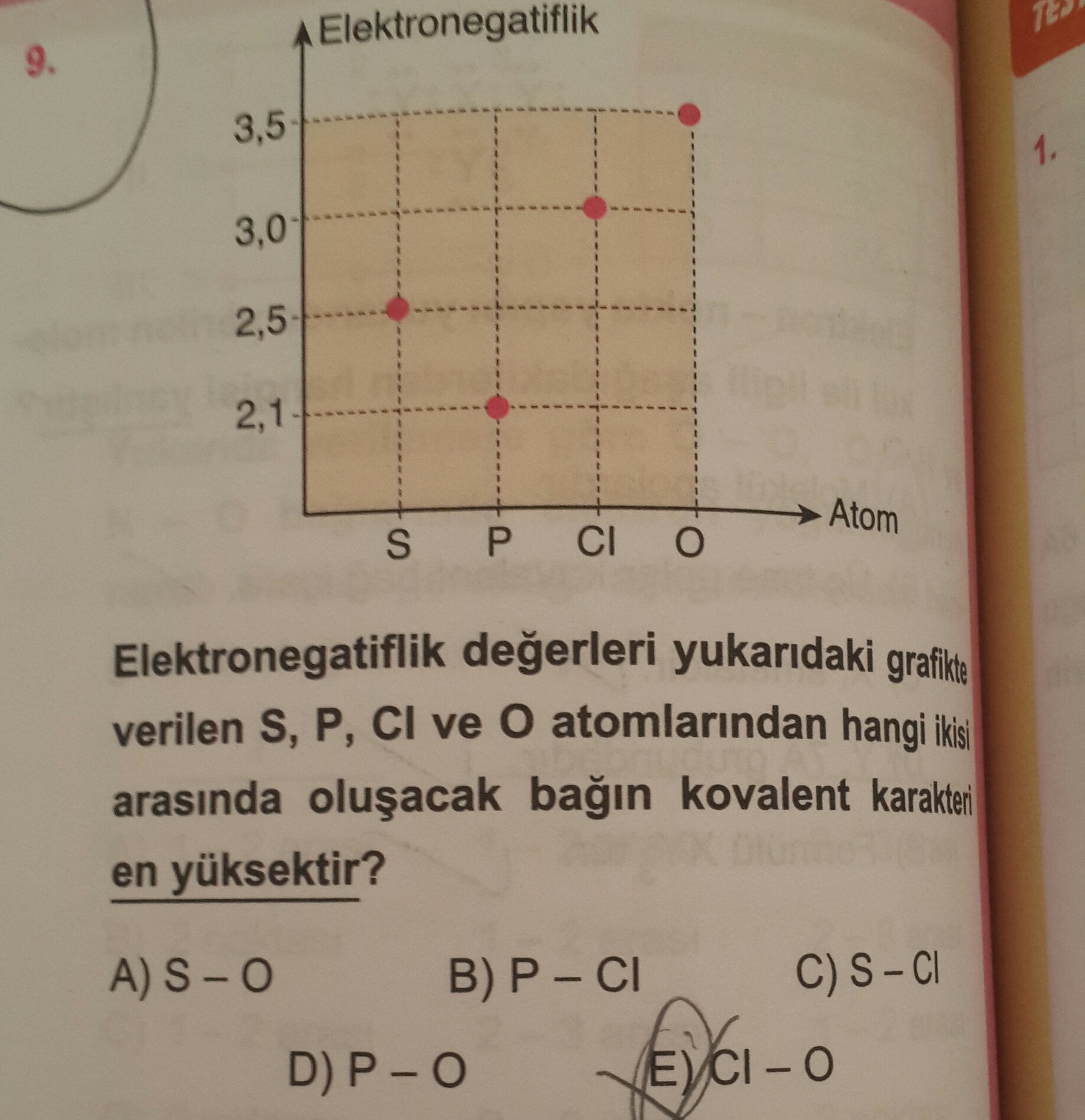
Kovalent karakter, bağ yapan atomlar arasındaki elektronların paylaşım derecesidir. Bu atomların elektronegatiflik farkı ne kadar düşükse, yani elektronları çekme güçleri ne kadar benzerse, kovalent karakter o kadar yüksek olur.
Kovalent Karakter Neye Bağlıdır?
Kovalent karakter şu faktörlere bağlıdır:
- Elektronegatiflik Farkı: Elektronegatiflik farkı arttıkça kovalent karakter azalır.
- Atom Boyutu: Atom boyutu arttıkça kovalent karakter artar.
- Valans Elektronlarının Sayısı: Valans elektronlarının sayısı arttıkça kovalent karakter artar.
Kovalent Karakter Nasıl Artar?
Kovalent karakteri artırmak için şu yöntemler kullanılabilir:
- Elektronegatiflik farkını azaltmak
- Atom boyutunu artırmak
- Valans elektronlarının sayısını artırmak
Kovalent Karakter Sıralaması
Bağlardaki kovalent karakter, elektronegatiflik farklarına göre şu şekilde sıralanabilir:
- İyonik Bağlar: Yüksek elektronegatiflik farkı (örn. NaCl)
- Kutuplu Kovalent Bağlar: Orta elektronegatiflik farkı (örn. HCl)
- Kovalent Bağlar: Düşük elektronegatiflik farkı (örn. H²)
İyonik bağlar genellikle metaller ve ametaller arasında oluşurken, kovalent bağlar genellikle ametaller arasında oluşur.






 Yeni Kayıt
Yeni Kayıt







 1 Mobil
1 Mobil
 Konudaki Resimler
Konudaki Resimler





 Hızlı
Hızlı 



















